Simulation chemischer Reaktionen in der Gasphase am Beispiel der heterogenen Gasphasenreaktion
Schwefelsäure ist eine der weltweit am meist verwendeten Chemikalien. Der Precursor ist Schwefeltrioxid, welches man katalytisch aus der Oxidation von Schwefeldioxid mit Luft über Pt oder V2O5 als Katalysator in einem exothermen Prozess erhält. Die Reaktionsführung in einem mikrostrukturierten Apparat bietet weit reichende Vorteile und ist Gegenstand intensiver Untersuchungen am IMVT. Hierzu wurde ein Mikroapparat entwickelt mit dem es möglich sein sollte, SO2 in einem einstufigen Prozess zu SO3, mit Pt als verwendeten Katalysator, zu oxidieren. Der Vorteil der Reaktionsführung in einem Mikroapparat ist, dass aufgrund der Einstufigkeit keine stufenweise Kühlung notwendig sein sollte. Wegen der korrosiven Eigenschaften des Schwefeltrioxids wird bei der Werkstoffwahl des Mikroapparats auf Titan zurückgegriffen.
Für die Experimente werden Schwefeldioxid/Sauerstoff-Mischungen unterschiedlicher Zusammensetzungen für verschiedene Verweilzeiten und Reaktionstemperaturen im Mikroapparat katalytisch umgesetzt. Aufgrund des Druckverlusts der Mikrokanäle kann davon ausgegangen werden, dass jeder Mikrokanal mit dem gleichen Massenstrom beaufschlagt wird. Temperaturmessungen zeigen die Stetigkeit der Temperaturverteilung; der Mikroapparat kann als isotherm angesehen werden. Jeder Mikrokanal verhält sich also gleich und es ist deshalb ausreichend, nur einen Einzelkanal bei der Simulation zu betrachten.
Die Reaktionsbedingungen für Experiment/Simulation sind in nachfolgender Tabelle aufgezeigt:
| Experiment | T,°K | Vol.flow_rate, ml/min STP |
mass_fraction YSO2, - | mass_fraction YO2, - | mass_fraction YN2, - |
|---|---|---|---|---|---|
| T9 | 673, 748, 803 | 833 | 0,28 | 0,28 | 0,44 |
| T7 | 673, 748, 793 | 840 | 0,35 | 0,35 | 0,3 |
| T5 | 673, 748, 808 | 483 | 0,22 | 0,23 | 0,55 |
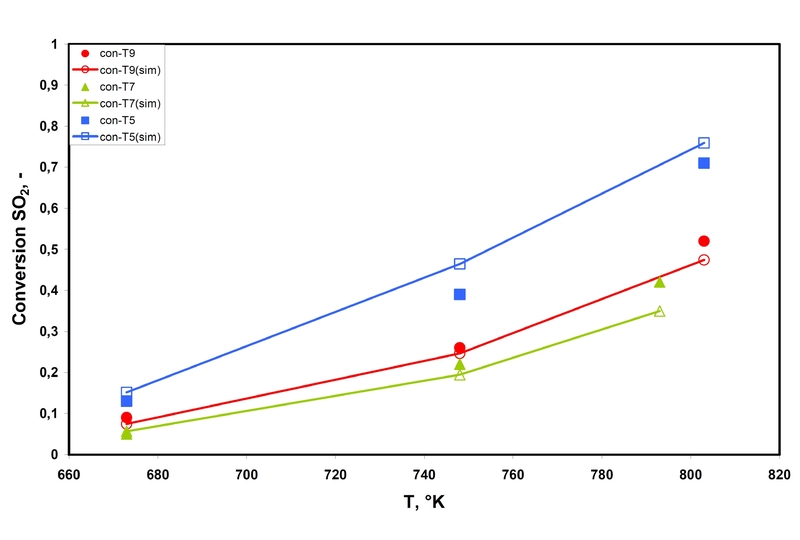 Abbildung 5: Umsatz von SO2 in Abhängigkeit von der Temperatur für die Experimente T9, T7 and T5. Gefüllte Symbole beschreiben experimentelle Werte; offene Symbole stehen für die simulierten Werte
Abbildung 5: Umsatz von SO2 in Abhängigkeit von der Temperatur für die Experimente T9, T7 and T5. Gefüllte Symbole beschreiben experimentelle Werte; offene Symbole stehen für die simulierten WerteAbbildung 5 zeigt den Umsatz von SO2 als Funktion der Temperatur für die in obiger Tabelle genannten Bedingungen. Es ist eine sehr gute Übereinstimmung zwischen Experiment und Simulation zu finden.
In Abbildung 6 sind Profile der Massenanteile der einzelnen Spezies und die Temperaturverteilung exemplarisch für das Experiment T9 (803K) dargestellt. Die Plots zeigen 2 Ebenen in der xz- als auch in der yz-Ebene entspre-chend der horizontal und vertikal orientierten Symmetrieebenen des halben Kanals. Die Temperatur wird auf der äußeren Oberfläche des Kanals gezeigt.
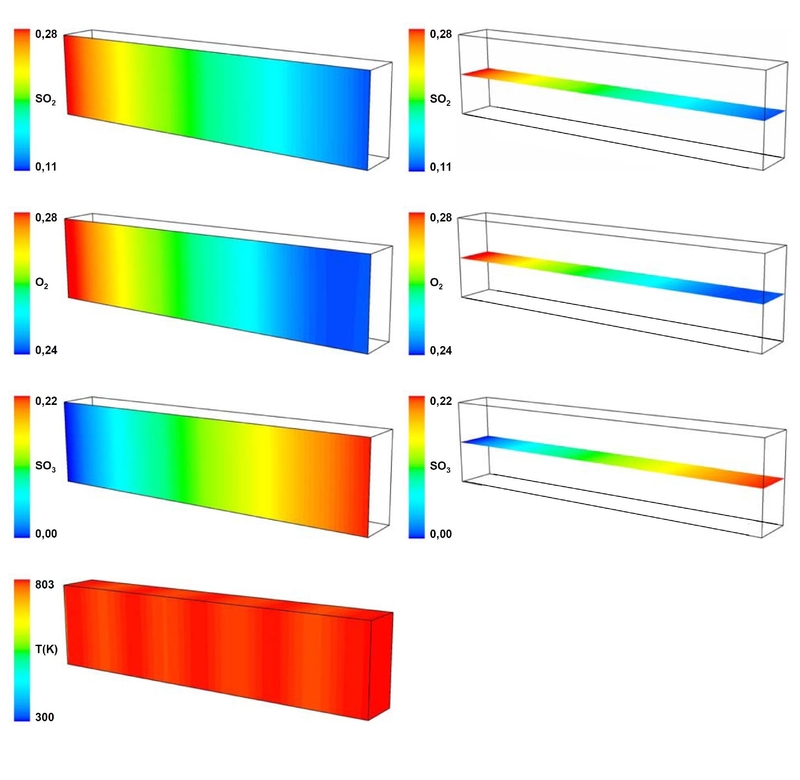 Abbildung 6: Profile der SO2, O2 und SO3 Massenanteile und der Temperatur in Abhängigkeit von der Kanallänge für das Experiment T9 für 803K; verschiedene Skalierungen in radialer und axialer Richtung. Strömungsrichtung von links nach rechts.
Abbildung 6: Profile der SO2, O2 und SO3 Massenanteile und der Temperatur in Abhängigkeit von der Kanallänge für das Experiment T9 für 803K; verschiedene Skalierungen in radialer und axialer Richtung. Strömungsrichtung von links nach rechts.Aus den Profilen ist ersichtlich, dass die Edukte über die gesamte Länge des Mikrokanals umgesetzt werden. Der Massenanteil des Produkts SO3 steigt bis zum Kanalaustritt an.
In radialer Richtung des Mikrokanals ist kein Gradient zu erkennen. Das Temperaturprofil zeigt in axialer als auch in radialer Richtung nahezu isotherme Bedingungen. Am Kanaleintritt fällt die Temperatur auf Werte kleiner 803K ab. Diese relativ kleine Zone ist in der Profildarstellung nicht zu erkennen. Auf der Kanaloberfläche sind geringfügige Farbunterschiede bei der Temperaturdarstellung zu erkennen. Diese sind auf Temperaturschwankungen in axialer Richtung zurückzuführen. Die Temperaturschwankungen betragen zwischen max. und min. Wert 15K.
Die Ursachen liegen in Wärmeverlusten an die Umgebung.
Bei der Simulation der SO2-Oxidation im Mikrokanal mit Pt als Katalysator unter Verwendung von ANSYS FLUENT 12.1 und einem Reaktionsmechanismus basierend auf Elementarreaktion kann gezeigt werden, dass die thermischen Vorgänge im Mikrokanal beschrieben werden können und der selbst entwickelte Reaktionsmechanismus die Kinetik der SO2-Umsetzung gut wiedergibt.
zurück